Non ci resta che arrenderci: siamo circondati. Dobbiamo arrenderci all’evidenza che siamo circondati dall’elettricità e che viviamo completamente immersi in un mondo pieno di dispositivi che funzionano solo grazie all’energia elettrica.
Sembra tutto abbastanza semplice quando pensiamo ai nostri elettrodomestici: hanno un cavo con una spina collegata a una presa nel muro da cui possono prendere tutta la corrente elettrica necessaria per funzionare. Ma quando pensiamo ai nostri smartphone, tablet, notebook, navigatori, droni, rasoi, tosaerba, depilatori, aspirapolvere, monopattini e auto elettriche viviamo nella paura costante che finisca la batteria piantandoci sul più bello in mezzo alla strada o, peggio ancora, a metà di una chat sui nostri social preferiti.
Per questo, diventa sempre più importante per noi poter disporre di batterie – più leggere e più piccole possibile – in grado di accumulare elettricità e fornircene quando serve e quanta ce ne serve finché non raggiungiamo una presa elettrica dove poterle ricaricare.
Per questo, anche se non lo sapevamo, dobbiamo ringraziare John B Goodenough, M Stanley Whittingham e Akira Yoshino per aver migliorato la nostra vita rendendo meno frequente e meno angosciosa la nostra continua ricerca di una presa elettrica. Evidentemente, la pensano così anche i membri dell’Accademia reale delle scienze svedese che li hanno premiati col Nobel per la chimica 2019.
Ciascuno dei tre, infatti, ha dato un contributo decisivo per lo sviluppo delle batterie al Litio. Anche se sono state ideate più di quaranta anni fa, restano ancora oggi le più efficienti e possiamo trovarle ovunque: nel cuore degli smartphone ma anche sotto il tappetino delle auto elettriche.
Le prime ricerche per trovare batterie ricaricabili più efficienti e più affidabili di quelle tradizionali a Piombo/acido solforico, Nichel/Cadmio e Nichel/Metallo Idruro, iniziano negli anni ’70 del secolo scorso spinte proprio dalla prima crisi petrolifera. La ricerca di fonti e vettori energetici alternativi porta a individuare il Litio come un possibile candidato per le batterie del futuro. Il litio, infatti, dopo l’Idrogeno e l’Elio è l’elemento più piccolo della Tavola di Mendeleev, ed è anche il più piccolo in assoluto che troviamo allo stato solido. Inoltre, può cedere facilmente uno dei suoi tre elettroni diventando uno ione positivo. Ma non basta, questo minuscolo ione positivo può inserirsi all’interno di materiali che si possono impiegare come elettrodi di una batteria e muoversi trasportando carica positiva fra un elettrodo e l’altro.
Ma interrompiamo un momento il nostro racconto per ricordarci come funziona una batteria: è un preziosissimo oggettino in grado di accumulare, immagazzinare e rilasciare energia elettrica al momento giusto. È fatta da due elettrodi (l’anodo collegato al polo negativo e il catodo collegato al polo positivo) separati da una barriera semipermeabile che lascia passare solo alcuni ioni trattenendo – o di qua o di là – tutti gli altri componenti della batteria.
Quando vogliamo caricare la batteria, colleghiamo i due poli alla nostra presa elettrica (grazie a un apposito trasformatore che porta la corrente alternata a 220V a corrente continua al giusto voltaggio). In questo modo, spingiamo elettroni lungo il filo elettrico collegato al polo negativo accumulandoli sull’anodo. Viceversa, con l’altro filo collegato al polo positivo aspiriamo una uguale quantità di elettroni dal catodo.
Quando, invece, vogliamo tirare fuori energia dalla nostra batteria, estraiamo dal polo negativo tutti gli elettroni che prima avevamo accumulato sull’anodo e li usiamo per produrre corrente elettrica. Questa corrente di elettroni passa attraverso il dispositivo utilizzatore – facendolo funzionare – e poi torna al polo positivo della batteria dove gli elettroni vengono accolti con gioia dagli ioni positivi che si trovano nel catodo e che non vedono l’ora di potersi ricongiungere ciascuno con un elettrone per tornare atomi neutri. Non proprio con l’elettrone che prima avevano perduto: va bene un elettrone qualsiasi. Tanto sono tutti uguali.
A questo punto, possiamo ricominciare il ciclo di carica e scarica… appena troviamo una presa per ricaricare.
Nelle batterie al Litio, in fase di scarica della batteria, gli elettroni portati via dall’anodo vengono da atomi di Litio che, perdendo ciascuno un elettrone, diventano ioni positivi di Litio. Questi ioni si muovono all’interno della batteria e passano attraverso la membrana arrivando al catodo e rimanendo qui in attesa che noi utilizziamo la batteria portando al catodo gli elettroni che avranno alimentato il nostro dispositivo. A questo punto, gli ioni di Litio, felicemente riaccoppiati ciascuno con un elettrone, se ne tornano all’anodo pronti per un altro giro.
È stato proprio Stanley Whittingham, che la Exxon aveva assunto per lavorare sulle batterie durante la crisi petrolifera, a pensare di usare il Litio per la facilità con cui dona gli elettroni. Anzi, in realtà, è lui stesso ad ammettere che ci è arrivato per caso mentre stava studiando nuovi materiali per superconduttori a base di disolfuro di Tantalio.
Fra il 1972 ed il 1976, Whittingham inventa una batteria dove il polo negativo è fatto di Litio metallico. Mentre per il polo positivo sceglie disolfuro di Titanio, un composto che all’interno del suo reticolo cristallino può ospitare comodamente proprio gli ioni Litio come il disolfuro di Tantalio ma che risulta molto più leggero e soprattutto … costa meno.
Questo è lo schema della batteria di Whittingham tratto (come gli schemi successivi) dal sito dell’Accademia reale delle scienze svedese.
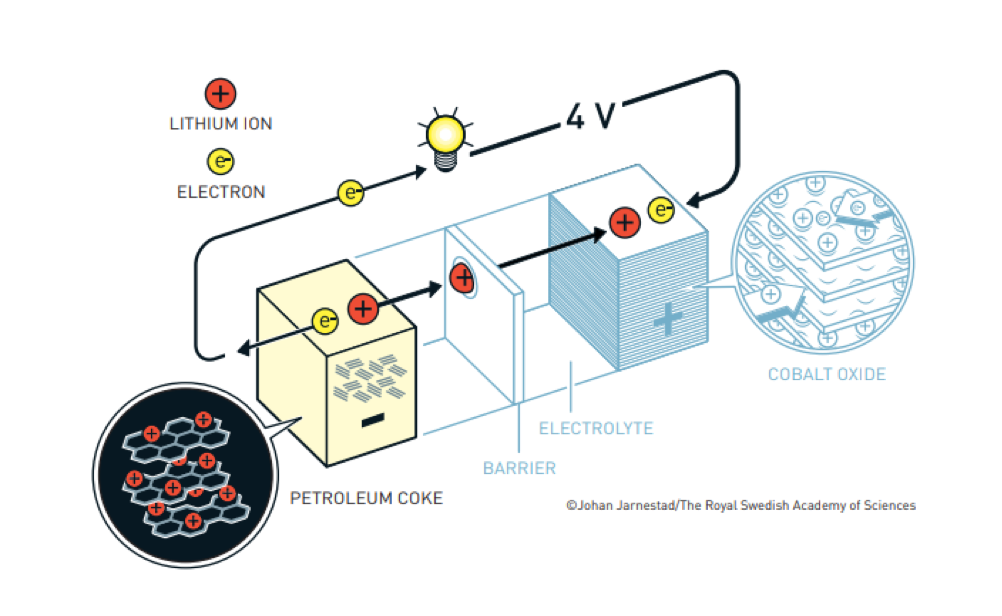 A questo punto, la storia delle batterie al Litio rallenta per due motivi. Il primo è che la crisi petrolifera termina, il prezzo del barile torna a scendere e la Exxon torna a concentrarsi soprattutto sul petrolio.
A questo punto, la storia delle batterie al Litio rallenta per due motivi. Il primo è che la crisi petrolifera termina, il prezzo del barile torna a scendere e la Exxon torna a concentrarsi soprattutto sul petrolio.
Ma, quello che è peggio, è che negli anni ‘80 il prezzo del barile crolla di nuovo e la compagnia è costretta ad abbandonare le ricerche sulle batterie per concentrarsi sul proprio business principale.
Il secondo motivo è più… tecnico. Infatti, durante i cicli di ricarica, gli atomi di Litio che tornano all’anodo dopo aver felicemente riconquistato il proprio elettrone al catodo, non hanno nessun motivo per tornare esattamente allo stesso posto che prima avevano occupato sull’anodo. Gli basta depositarsi sulla sua superficie esterna. Gli atomi successivi, ancora più pigri, invece di arrivare fino all’anodo si depositano sui primi e poi quelli che vengono dopo si attaccano sui precedenti fino a creare dei filamenti metallici (che i ricercatori chiamano vibrisse di gatto). Quando queste vibrisse, diventando sempre più lunghe, arrivano a toccare il catodo, la batteria va in cortocircuito e il litio metallico… esplode. Cosa molto poco gradevole se capitasse dentro il nostro smartphone o, peggio, sotto il tappetino della nostra auto elettrica.
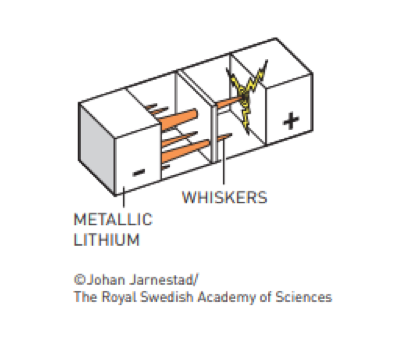 Le ricerche di Whittingham vengono interrotte quando la locale stazione dei pompieri – dopo essere stata chiamata decine di volte a fermare gli incendi – minaccia il laboratorio di addebitare le spese per gli speciali estinguenti necessari per spegnere il litio metallico.
Le ricerche di Whittingham vengono interrotte quando la locale stazione dei pompieri – dopo essere stata chiamata decine di volte a fermare gli incendi – minaccia il laboratorio di addebitare le spese per gli speciali estinguenti necessari per spegnere il litio metallico.
Ecco che nella nostra storia entra in scena John B. Goodenough. Pensate che da bambino aveva problemi ad imparare a leggere, per questo decise di concentrarsi sui numeri… e da qui a diventare professore di fisica a Oxford il passo è stato breve. Almeno per lui.
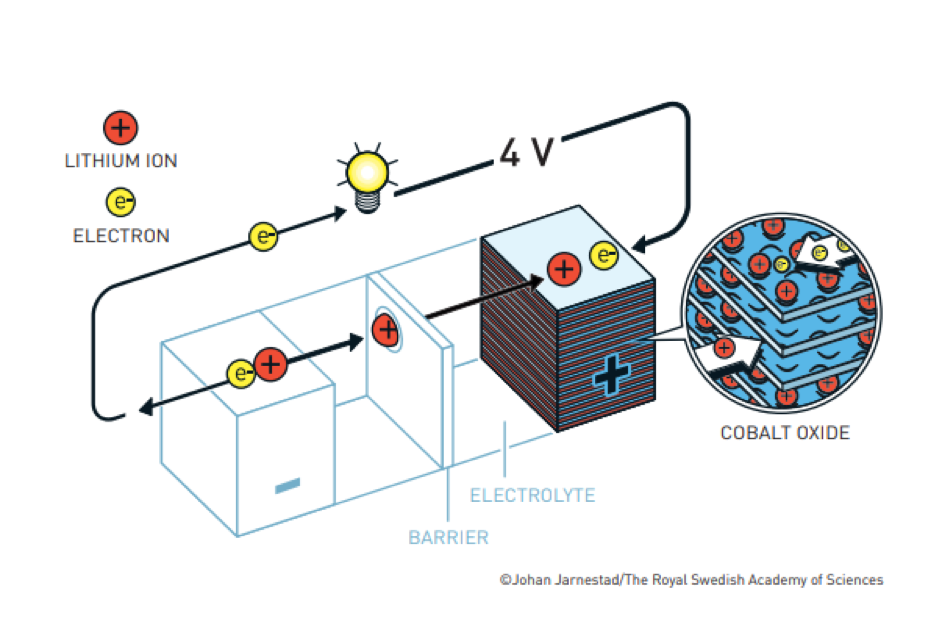
Con il suo gruppo di ricerca, Goodenough riprende le ricerche abbandonate da Whittingham e nel 1980 sostituisce il disolfuro di Titanio nel catodo con l’ossido di Cobalto. In questo modo, non solo è possibile costruire batterie nel loro stato scarico e poi caricarle, mentre il modello Exxon doveva essere realizzato già nello stato carico, ma soprattutto aumenta la differenza di potenziale fra i due poli della batteria, raddoppiandola dai 2 Volt del modello di Whittingham a ben 4 Volt.
 Ma a questo punto della nostra storia il prezzo del petrolio torna a diminuire e in occidente cala anche l’interesse per l’elettricità. Dall’altro lato del pianeta, però, in quegli stessi anni sta avvenendo una rivoluzione elettronica. Le industrie giapponesi si stanno scatenando nella produzione dei primi dispositivi a transistor: personal computer portatili, videocamere, telefoni senza fili e walkman. Per questo, hanno bisogno di batterie leggere e potenti per alimentare i dispositivi con i quali stanno invadendo il mercato mondiale.
Ma a questo punto della nostra storia il prezzo del petrolio torna a diminuire e in occidente cala anche l’interesse per l’elettricità. Dall’altro lato del pianeta, però, in quegli stessi anni sta avvenendo una rivoluzione elettronica. Le industrie giapponesi si stanno scatenando nella produzione dei primi dispositivi a transistor: personal computer portatili, videocamere, telefoni senza fili e walkman. Per questo, hanno bisogno di batterie leggere e potenti per alimentare i dispositivi con i quali stanno invadendo il mercato mondiale.
Ed è questo il momento di Akira Yoshino, che fin da piccolo, era preso in giro dai compagni di classe per il naso grosso. Oggi sostiene che proprio il suo fiuto lo convinse che quello era il momento giusto per lavorare sulle batterie. Così, alla Asahi Kasei Corporation, prova a modificare il polo negativo della batteria di Whittingham e Goodenough sostituendo il Litio metallico dell’anodo prima con grafite, che però si danneggia dopo pochi cicli di carica e scarica, e infine – nel 1986 – con carbon coke, un sottoprodotto del petrolio.
In questo modo, raggiunge tre vantaggi: taglia le vibrisse al gatto evitando i cortocircuiti, stabilizza l’anodo evitando l’esplosione del Litio metallico e, se vogliamo, entra di diritto fra i pionieri dell’economia circolare riutilizzando un sottoprodotto petrolifero di difficile commercializzazione.
È giunto il momento per avviare la produzione di massa: le batterie al Litio negli ultimi trent’anni hanno praticamente eliminato ogni altra precedente tecnologia; con l’eccezione delle batterie Piombo/acido solforico che da oltre cent’anni trovano spazio accanto al motorino di avviamento sotto il cofano delle auto a benzina e diesel.
A questo punto, la storia dei tre moschettieri delle batterie al Litio e del premio Nobel che hanno meritato termina qui. Ma la storia delle batterie è ancora ben lontana dalla conclusione. Infatti, le moderne batterie al Litio sono in grado di accumulare ben 2,5 MJ di energia per ogni Kg di peso, ma non sono ancora in grado di competere efficacemente con il diesel e la benzina, che in un solo Kg riescono a racchiudere 54 MJ, o con l’idrogeno, che arriva a 143 MJ/Kg.
Ecco perché, in attesa che le ricerche dei tre moschettieri siano portate avanti da un futuro D’Artagnan, le auto elettriche restano molto pesanti e con scarsa autonomia. Ed ecco perché noi siamo sempre a caccia di una presa elettrica per ricaricare i nostri dispositivi mobili.
Articolo pubblicato su eniday.it






