In questo lungo post, tecnico ma (spero) non troppo, spiego perché da un punto di vista virologico, e non solo clinico, Omicron è un virus di patogenicità ridotta rispetto alle precedenti varianti di SARS-CoV-2. La speranza è che dopo averlo letto risulterà chiaro che negare questo fatto, tanto semplice quanto inconfutabile, significhi ignorare le basi virologiche della patogenesi di COVID – e questo naturalmente ci può stare, perché nessuno sa tutto di tutto. Ma, escludendo la malafede, quello che non ci dovrebbe stare, e che infatti rappresenta un errore piuttosto grave e dannoso, è il parlare in pubblico, ed ancor peggio in televisione, di cose che non si conoscono. E qui va detto che errore analogo lo fa chi organizza tali trasmissioni ed invita persone che parlano, a volte spacciandosi da esperti, di cose che chiaramente non conoscono. La virologia, come la matematica, non è un’opinione, e diffondere disinformazione al pubblico non è una cosa buona.
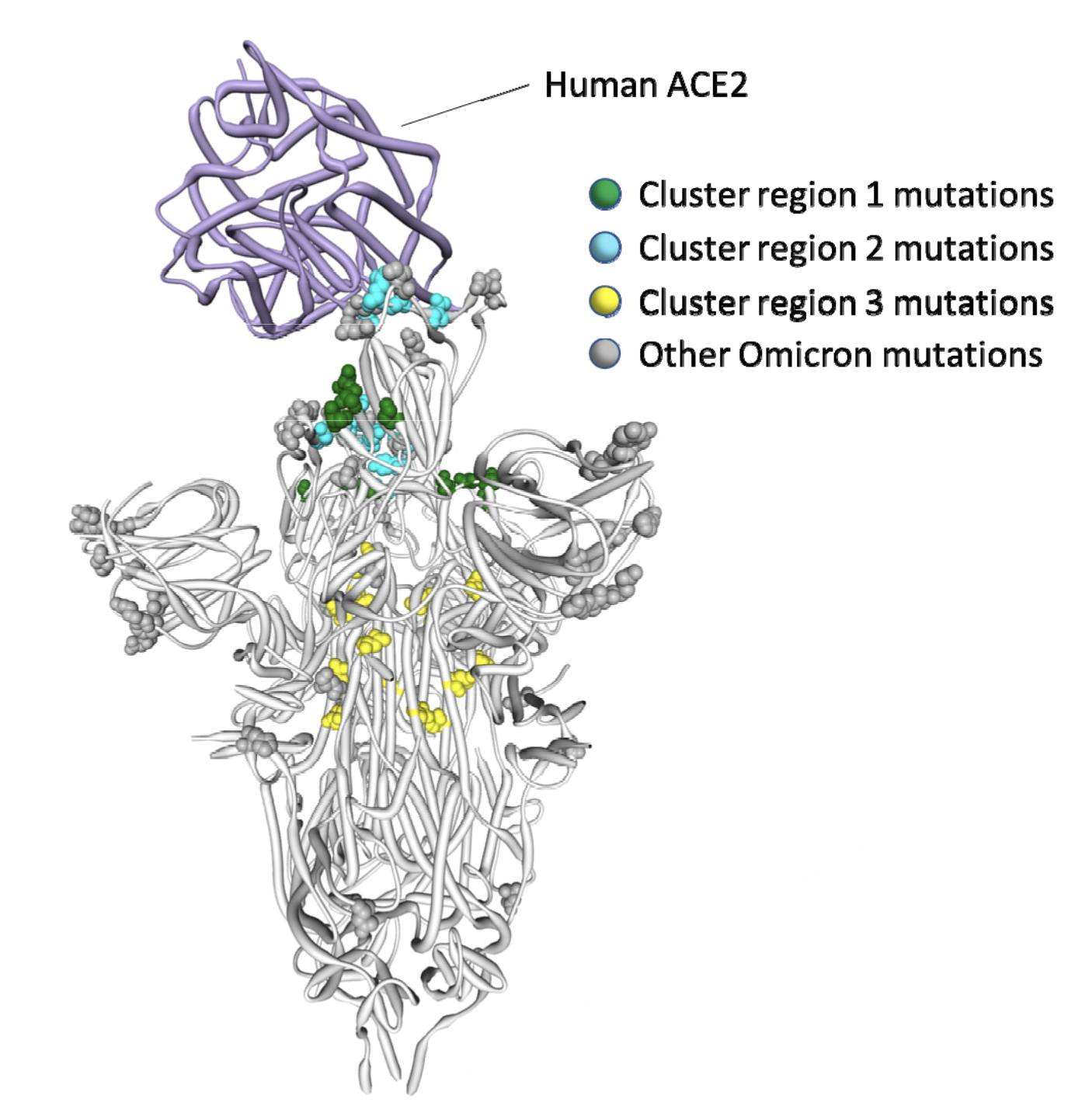
Ma passiamo alle cose di virus. La variante Omicron di SARS-CoV-2, incluse le sue sottovarianti, ha una lunga serie (circa 30, dipende da come le si contano) di mutazioni aminoacidiche nella proteina Spike, quella che il virus usa per entrare nelle cellule dell’ospite agganciandosi al recettore cellulare ACE-2. Di queste mutazioni genetiche circa la metà sono specifiche di Omicron, cioè non si trovano in altre varianti di SARS-CoV-2 (comprendendo il virus iniziale, Wuhan, e le varie Alpha, Beta, Delta etc). Le mutazioni specifiche della Spike di Omicron sono raggruppate in tre “clusters”, che sembrano determinare degli important cambiamenti in alcune funzioni specifiche di questa proteina, tra cui l’affinità per il recettore ACE-2, la capacità di sfuggire agli anticorpi indotti artificialmente dai vaccini e/o da una infezione naturale pre-esistente, e la capacità di disporsi nelle posizioni alternative “up” e “down” (più o meno, a testa in su o a testa in giù) nel formare il trimero di Spike. Su alcune di queste mutazioni ci sarebbero molte cose interessanti da dire, ma si esulerebbe dal tema di questo post, e quindi rinvio quella chiacchierata a data da destinarsi.
Ora entriamo nel vivo della questione centrale di questo post, cioè se sia vero oppure non vero che Omicron sia meno patogenico delle altre varianti di SARS-CoV-2. Per poter rispondere a questa domanda in modo informato, il punto primo da capire è che il raggruppmento (“cluster”) di mutazioni amino-acidiche tipiche di Omicron che influenza direttamente la patogenicità di questo virus si trova nella zona funzionale di Spike che comprende sia la giunzione tra la parte o subunità S1 della molecola (quella che si lega a ACE-2 tramite il cosiddetto “receptor binding domain”) e la parte S2 (quella che sta per lo più all’interno della membrana esterna del virus), dove le due subunità vengono clivate o separate tra loro, sia la parte cosiddetta N-terminale (o, se vogliamo, superiore) di S2, quella che contiene il cosiddetto “fusion domain” (dominio di fusione), che permette alla membrana virale di fondersi con la membrana cellulare durante l’ingresso del virus nella cellula ospite. Sembra difficile, lo so, ma in realta non lo è, basta andare piano, una frase alla volta ed una parola alla volta, e ci si arriva.
Ma ora facciamo un passo indietro, per andare a vedere in modo più preciso e definito cosa succede quando questo virus entra nelle cellule che infetta, le quali, come sappiamo, sono le cellule delle vie respiratorie superiori e quelle del polmone profondo (in quest’ultimo caso causando la ben nota polmonite interstiziale con danno alveolare diffuso, quell ache manda i pazienti in terapia intensiva e/o in respirazione assistita). Numerosi studi in vitro hanno dimostrato come SARS-CoV-2 usi due meccanismi tra loro molto diversi ed alternativi per entrare nella cellula dell’ospite. Il primo meccanismo si chiama “endocitosi mediata dal recettore”, che il virus usa per entrare nelle cellule del polmone profondo, e che consiste nella internalizzazione del virus dopo che si è attaccato al recettore ACE-2. Il secondo meccanismo si chiama “endocitosi mediata da fusione di membrana”, che il virus usa per entrare nelle cellule delle vie respiratorie superiori, e che consiste nella internalizzazione del virus dopo che la sua membrana esterna si è fusa con quella della cellula ospite.
Dal punto di vista della virologia molecolare – quella che a me piace considerare la “virologia vera”, e che, mi sembra di capire, riesce un filino ostica da digerire ai fenomeni di Twitter che pensano di imparare questa materia studiandola su google o wikipedia – la cosa più interessante sta nelle interazioni tra questa porzione di Spike ed alcuni prodotti genici dell’ospite. In particolare, si deve osservare che la “endocitosi mediata dal recettore” è facilitate da un enzima cellulare transmembranario (una serina-proteasi, per l’esattezza) chiamato TMPRSS2, che taglia la Spike in S1 e S2 (il cosiddetto “priming” della Spike) e la rende di conseguenza più brava a far entrare il virus nei polmoni. Invece la “endocitosi mediata da fusione di membrana” deve aggirare, per risultare efficace, il blocco rappresentato da una proteina cellulare anch’essa transmembranaria chiamata IFITM-1, che dipendente dall’interferone di tipo I (“Type-I Interferons), che inibisce la fusione tra le membrane di virus e cellula necessaria per entrare nelle cellule delle alte vie respiratorie.
Ok, tutto molto bello, ma cosa è successo con Omicron che è così straordinariamente diverso da tutte le altre variant di SARS-CoV-2? Resistete ancora un po’, e si capisce tutto, ve lo prometto. E’ successo che grazie a questo “terzo clusters” di mutazioni nella Spike di cui abbiamo parlato qui sopra, il virus Omicron è diventato sostanzialmente resistente al blocco causato da IFITM-1, e quindi si è specializzato ad entrare nelle cellule respiratorie superiori usando la “endocitosi mediata da fusione di membrana” (per questo motivo, come sostenuto da Tony Fauci, si parla di virus che si sta “raffreddorizzando” o “influenzizzando”). Nel contempo, tramite le stesse sostituzioni specifiche a livello di sequenza amino-acidica, Omicron ha rinunciato alla capacità di essere processato da TMPRSS2, così perdendo l’abilità di usare come meccanismo d’ingresso nelle cellule la “endocitosi mediata dal recettore”, e quindi diventando largamente inefficace nell’infettare il polmone profondo. Ecco perché questa è una caratteristica così importante di Omicron. Ci siamo vero? E si capice dove stiamo andando a parare, no?
Passando dalla virologia molecolare ad un altro mio grande amore, cioè lo studio della patogenesi delle malattie virali nell’animale da esperimento, sono presto arrivati una serie di studi molto eleganti (ed indipendenti tra loro!) a confermare questo modello di patogenesi virale – perdonatemi, si dice proprio così – dimostrando senza ombra di dubbio come Omicron induca, sia nel topo che nel criceto, una malattia delle vie respiratorie superiori che risulta molto più lieve della malattia prevalentemente polmonare indotta negli stessi animali dalle varianti precedenti di SARS-CoV-2. Passando ai dati clinici, che ormai sono sotto gli occhi di tutti, Omicron risulta meno severo delle varianti precedenti, ed in particolare di Delta (che tra queste era la più “cattiva”), proprio perché è meno capace di causare una malattia polmonare severa, esattamente come previsto sia dalla virologia molecolare in vitro che dagli studi sugli animali (ma la scienza non è acqua, d’altronde).
Da un punto di vista della biologia virale analizzata in termini evoluzionistici, il fatto che Omicron abbia soppiantato così rapidamente e così universalmente le altre varianti di SARS-CoV-2, compresa la temutissima Delta, dimostra in modo molto convincente come, per questo virus, la scelta di cedere una porzione importante di patogenicità per acquisire un vantaggio notevole in termini di trasmissibilità è stata vincente al 100%, in termini di percentuale di virus circolante, ed ovunque, visto che per quanto ne sappiamo Omicron sta circolando in modo dominante in tutti i paesi del mondo. Se a questo punto mi permettete di togliermi un (facile) sassolino dalla scarpa, questa bellissima storia dimostra che avevamo perfettamente ragione nel 2020 prevedendo una evoluzione del virus verso una minore cattiveria associate ad una maggiore trasmissione (sbagliandoci solo sulla tempistica, in quanto Omicron è arrivata a fine 2021 anziché a fine 2020, ma nessuno è perfetto).
Che poi questa cosa era anche abbastanza intuitiva trattandosi di un virus respiratorio a grande diffusione. Come scrisse già dal maggio 2020, quando Omicron neppure esisteva, il grande Roberto Burioni – e pure lui di questa roba se ne intende non poco – un virus che viene trasmesso da persone che hanno pochi sintomi ha più chances di diffondersi di un virus che rende le persone gravemente ammalate. D’altronde, non era un caso che i quattro coronavirus umani endemici (229E, NL63, OC43 e HKU1) causino tutti malattie relativamente lievi e stagionali dell’apparato respiratorio superiore. Poi, naturalmente, ci sono sempre i soliti sapientini che ne sanno di più di noi – che pure facciamo questo lavoro da 30 anni ed anche con un certo successo – ed a cui piace punzecchiarci sui social (ma non nei congressi veri, perché lì, chissà mai perché, di sapientini che vengono a sfotterci non si vede manco l’ombra). Ma nella vita ci vuole tanta pazienza, dico bene? E noi tanta pazienza avremo…
PS: mi aspetto l’obiezione: “ma allora come mai in Italia muoiono così tante persone di COVID?”. Su questo torneremo nei prossimi giorni, provando a capire quante di queste persone muoiano effettivamente a causa di COVID (e non “con” COVID) guardando ai dati sulla mortalità in eccesso e cercando di capire perché la letalità calcolata in Italia sembra al momento molto più alta di altri paesi europei.
Referenze:
Shuai, Nature 2022
Halfmann, Nature 2022
Zhao EID 2022
Gupta Res Sq 2022
Martin DP et al BiorXiv 2022
Willett et al. medRxiv 2022
Peacock TP et al. BioRxiv 2022
Meng, B. et al. BioRxiv 2021
Jassat W et al. SSRN Journal 2021
Davies M-A et al. medRxiv 2022